“纳米催化医学”是由中国科学院院士、中国科学院上海硅酸盐研究所施剑林研究员所带领的科研团队提出的前沿学术思想,旨在通过响应肿瘤部位的特异内场微环境或外源性激光、超声作用场,利用无毒/低毒纳米材料所引发的瘤内原位催化反应,高效地实现肿瘤细胞的氧化损伤及细胞死亡。这一催化肿瘤治疗方法不使用高毒性化疗药物,具有其高效、特异性强、安全性高的特点,得到了广泛同行的认可,近年来得以迅速发展。
近日,该科研团队在“纳米催化医学”的肿瘤治疗领域再次取得突破,四项相关研究成果分别聚焦于老药新用协同纳米催化肿瘤治疗、抑制细胞自噬增强内场响应催化肿瘤治疗、外场激发光合作用增强光动力学催化治疗以及外场超声引发压电催化肿瘤治疗。工作引发了广泛关注。
一、类Fenton催化反应协同老药新用的肿瘤治疗
通过将纳米催化剂引入肿瘤微环境中或者癌细胞内引发的原位催化反应(尤其是产生活性氧物种羟基自由基·OH的芬顿反应)会使得癌细胞受到剧烈的氧化损伤而发生凋亡。基于之前铁基Fenton催化剂的纳米催化肿瘤治疗,进一步与其他治疗模式向结合,可以实现基于催化肿瘤治疗的协同治疗模式。
该研究团队使用一类原用于酒精中毒的老药--双硫仑,通过与铜离子的螯合产生针对肿瘤的药物毒性,同时类Fenton催化剂铜离子进一步催化Fenton反应瘤内产生活性氧物种,达到协同治疗肿瘤目的。如图1所示,采用掺铜的介孔氧化硅为载体,将低毒的双硫仑药物和铜离子输运至肿瘤。通过特异性响应肿瘤的弱酸性,介孔氧化硅快速降解,同步在瘤内释放出药物双硫仑和二价铜离子。于是双硫仑在瘤内原位与铜离子螯合,一方面明显增强其毒性,同时产生的一价铜离子催化肿瘤内高表达的过氧化氢的歧化反应,产生大量的高细胞毒性的羟基自由基,从而达到低毒副作用的肿瘤特异性协同治疗。进一步以普鲁士蓝纳米颗粒作为载体,实现光热辅助的化疗-纳米催化协同肿瘤治疗。
文章信息:Journal of the American Chemical Society, 141, 29, 11531-11539. DOI: 10.1021/jacs.9b03503
文章信息:Adv. Mater., 2020, 32, 2000542, DOI: 10.1002/adma.202000542
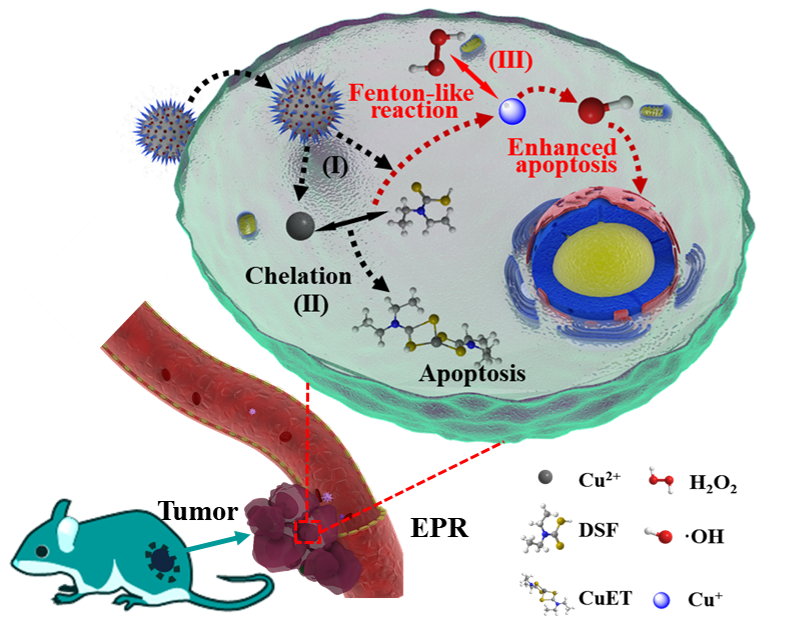
图1.双硫仑螯合铜离子并引发Fenton反应,达到化疗与催化肿瘤治疗的协同治疗效果
二、抑制细胞自噬增强内场响应的催化肿瘤治疗
纳米催化剂在肿瘤微环境中的原位芬顿催化反应产生活性氧物种羟基自由基·OH,以达到杀灭肿瘤细胞目的。然而,在氧化应激的作用下,癌细胞能够通过激活自身的自噬通路降解受到损伤的细胞内的大分子和细胞器,实现体内废物的有效清除,降低活性氧如·OH对癌细胞的毒性。因此,抑制癌细胞的自噬是增强纳米催化治疗的有效手段,让癌细胞在氧化应激下无法进行“自我解毒”,最终凋亡。
为了实现这个构想,近日,该科研将具有强催化能力的铁基的MOF纳米催化剂和自噬抑制剂氯喹联用(图2)。MOF (Fe)纳米颗粒在酸性环境中可以表现出类过氧化物酶的性质,能够将H2O2分解为具有强氧化性的·OH。由于肿瘤微环境和癌细胞内环境呈弱酸性,MOF (Fe)的这种催化能力可以很好地显示出来,对癌细胞造成氧化损伤。另外,氯喹作为一种FDA批准的老药,可以自动地在癌细胞的溶酶体内富集,并升高溶酶体内的pH,从而抑制溶酶体内蛋白酶的功能,最终阻断自噬流。这两者在一起联用会使得癌细胞在受到氧化损伤的同时无法通过自噬降解掉这些损伤的物质,导致这些物质的积累,从长期来看又会加重对癌细胞的毒性,从而增强纳米催化治疗的效果。动物实验结果显示,氯喹的使用显著增强了MOF (Fe)纳米催化剂对A375黑色素瘤和HeLa宫颈癌肿瘤的生长的抑制作用,实现了“1 + 1 > 2”的效果。
文章信息:Adv. Mater., 2020, 32, 1907152, DOI: 10.1002/adma.201907152
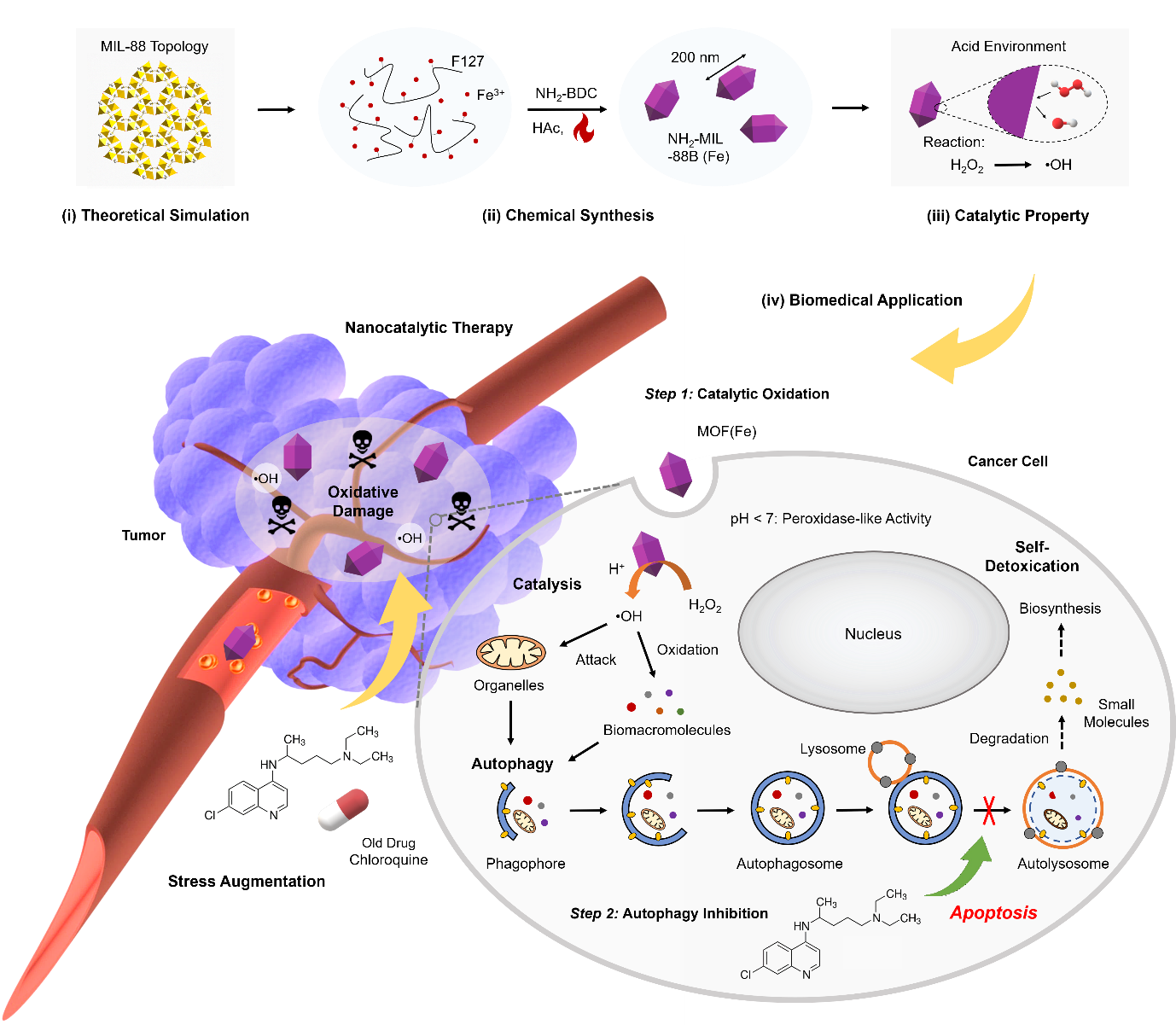
图2. 利用氯喹抑制自噬通路增强纳米催化治疗的原理示意图
三、外场激发光合作用增强光动力学催化治疗
肿瘤的光动力学治疗(PDT)是一种古老而有效的外场激发肿瘤治疗模式。在临床上,由于大量开发的光敏剂产生单线态氧物种的原理是基于分子氧的三线态湮灭,因此,肿瘤的乏氧特征一直是限制基于II型光敏剂的光动力学治疗的重要因素。近年来对于肿瘤增氧提高肿瘤PDT治疗效果有较多报道,然而利用物理载氧及化学产氧的方式来增效PDT存在着效率不足及生物安全性的问题,开发一种新型的肿瘤充氧方式来增效肿瘤的光动力学治疗有助于解决临床肿瘤光动力学应用的瓶颈。
受蓝藻远古光合作用的启发,近日,该科研团队构建了一种光敏剂二氢卟吩(ce6)与蓝藻(细长聚球藻)杂化的光敏细菌用于光激发下的光合作用增强肿瘤的PDT治疗(图3)。基于蓝藻叶绿素结构与光敏剂结构的相似性,这一光敏细菌能够实现在单一光源激发下(660 nm)的光合作用及光敏剂活化,使得敏化后的二氢卟吩光敏剂能够迅速与分子氧发生三线态湮灭生成单线态氧物种,对肿瘤细胞造成高效杀伤,为克服II型光敏剂的氧依赖提供一种基于生物放氧的增效方案。
研究表明,光敏蓝藻细菌能够实现在较低的660 nm激光功率下(20 mW cm-2)及低杂化光敏剂剂量的条件下高效的细胞毒性,对比游离状态的光敏剂ce6,其发挥半数细胞杀伤效力所需的光敏剂浓度仅为游离光敏剂浓度的1/18。进一步在体内动物实验层面,研究团队以瘤内注射的模式实现了光敏蓝藻细菌对肿瘤移植瘤最高79.9%的体积抑制,并在长达1个月的安全性评价周期内展示出优异的生物安全性。该项研究探索了一类具有相当潜力的光合-光敏生物杂化材料,更为基于光动力学的临床瓶颈问题提供了新的解决思路。
文章信息:Angew. Chem. Int. Ed., 2020, 59(5): 1906-1913. DOI:10.1002/anie.201912824
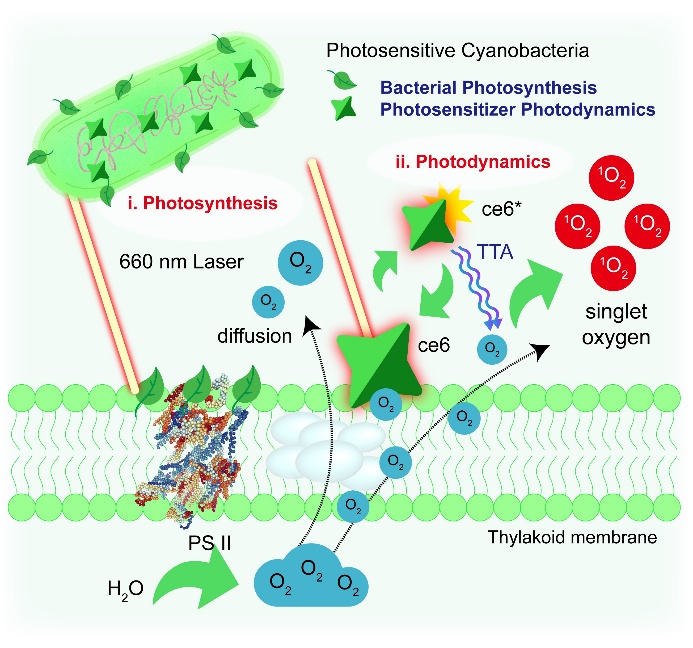
图3. 光敏蓝藻细菌的光激发光合作用增敏PDT示意图
四、外场超声引发压电催化肿瘤治疗
癌症仍然是世界范围内的公共卫生问题,对于癌症的治疗,化疗仍然是必不可少的手段。但是传统的化疗属于全身性用药,不仅药效低,毒副作用强,而且容易产生耐药性。近日,该科研团队提出了一种全新的“压电催化”的新型肿瘤治疗模式,将压电催化剂作为纳米功能药物,利用高穿透性外源超声的微观压力作用,通过压电催化反应产生的活性氧物种对肿瘤细胞进行杀伤,同时避免了对正常组织产生毒副作用。
在该项研究中,研究团队选取超声作为外场激发源。超声作为一种非侵入式、高穿透性的外源,在临床上常被用于疾病的诊断与治疗,其传播过程中的声荧光也常常被用来激发声敏剂进行声动力肿瘤治疗(图4)。而实际上,超声作为一种机械波在其传播过程中,还伴随着周期性的应力作用,最高可达108 Pa。研究团队首先合成了粒径约为110 nm的立方相钛酸钡纳米颗粒,并在800 oC煅烧处理后,转变成非中心对称的压电性四方相钛酸钡纳米颗粒。该纳米颗粒在超声的作用下可以有效地降解亚甲基蓝,利用电子自旋共振技术,确定了在该过程中产生了超氧阴离子和羟基自由基。而通过能带结构分析,所合成的四方相钛酸钡纳米颗粒是不满足产生超氧阴离子和羟基自由基的条件。通过模拟计算,在超声微观压力作用下,110 nm四方相钛酸钡纳米晶模型可以产生的压电势最大可达0.45 V,并且随着模型粒径的增大而增大。该压电势足以倾斜能带,使其倾斜至动力学上满足同时产生超氧阴离子和羟基自由基的条件的方向。另外也对中心对称性的立方相钛酸钡纳米颗粒进行对照实验,发现该纳米颗粒在超声处理下并不能降解亚甲基蓝,在该过程中也未检测到自由基,说明由于非中心对称性导致的压电性,是该研究中的关键。
该团队将超声激发的压电催化反应产生自由基的过程应用于肿瘤治疗。为了提高纳米功能药物的富集量,利用温敏性水凝胶与四方相钛酸钡纳米颗粒进行复合,在体温下发生相变,将四方相钛酸钡纳米颗粒固定在肿瘤区域,同时避免了对正常组织的影响。在细胞层面,超声处理后可以明显地观察到细胞死亡,同时在细胞层面检测到了活性氧物种。在动物层面,通过瘤内注射四方相钛酸钡纳米颗粒与温敏性水凝胶的复合物,在超声处理后,可以观察到显著的肿瘤清除效果,并且对小鼠的正常器官,以及血液指标都没有影响,表明具有较好的体内生物安全性,生命周期延长至40天以上。
文章信息:Adv. Mater., 2020, DOI: 10.1002/adma.202001976.
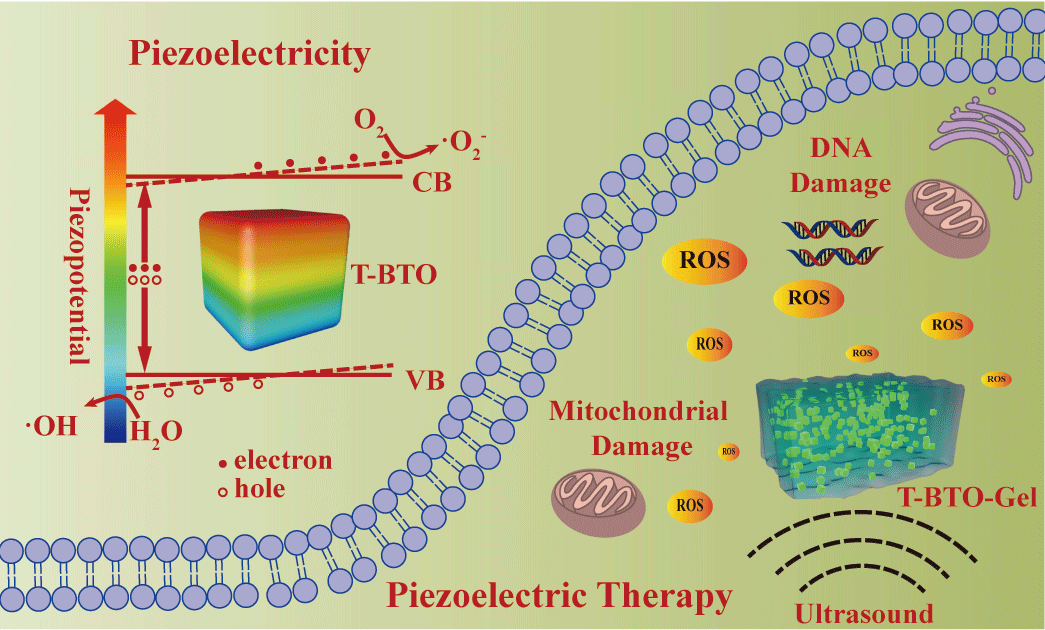
图4. 基于压电催化剂的压电催化反应用于肿瘤治疗的示意图
以上各项研究的第一作者分别是吴文柽、杨博文、霍敏锋和朱飘。
此外,纳米催化医学科进一步拓展至其他疾病治疗领域,并取得进展。如用于抗菌(Small, 2019, 15, 1901834. DOI: 10.1002/smll.201901834); 保护血脑屏障并治疗脑卒中等ACS Nano, 2018, 12, 6794-6805. DOI: 10.1021/acsnano.8b01994)
以上工作得到了国家自然科学基金、国家重点研发计划“青年科学家”专项、上海市自然科学基金会、上海市优秀学术带头人计划等的资助和支持。


 当前位置:
当前位置:

